|
SERWIS ELEKTRONICZNY - RADIOELEKTRYKA SOSNOWIEC POLSKA |
|
NIEZALEŻNA DZIAŁALNOŚĆ BADAWCZO - NAUKOWA KLIKNIJ NA OPIS DOKUMENTU |
|
|
|
Zagrożenia
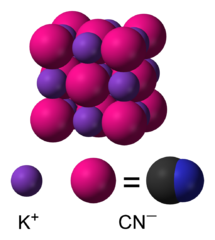
Cyjanowodór w papierosach - tytoń fajkowy (silnie trujący) [mg/dm³] Skutki działania Związek
chemiczny Cyjanowodór, HCN – nieorganiczny związek chemiczny zbudowany z
wodoru, węgla i azotu, będący bezbarwną, lotną i silnie trującą
cieczą o zapachu gorzkich migdałów. Z wodą tworzy słaby kwas
cyjanowodorowy, którego sole noszą nazwę cyjanków. |
|
|
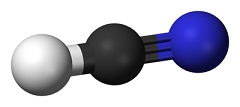
Cyjanowodór, HCN
– nieorganiczny związek chemiczny zbudowany z wodoru, węgla i azotu,
będący bezbarwną, lotną i silnie trującą cieczą o zapachu gorzkich
migdałów (który może być jednak niewyczuwalny przez niektóre osoby).
Z wodą tworzy słaby kwas cyjanowodorowy (kwas pruski), którego sole
noszą nazwę cyjanków. Znalazł zastosowanie w syntezie i analizie
chemicznej oraz jako pestycyd. W czasie II wojny światowej był
stosowany w postaci insektycydu Cyklon B do trucia więźniów
niemieckich obozów zagłady. Zalicza się go do ogólnotrujących
bojowych środków trujących i jest wpisany do wykazu 3. Konwencji o
zakazie broni chemicznej. |
|
Skala
przemysłowa Dawniej cyjanowodór otrzymywano przemysłowo przez zakwaszanie
cyjanków (np. NaCN lub Ca(CN)2). Obecnie stosowane są trzy procesy
przemysłowe otrzymywania cyjanowodoru – proces Andrussowa, proces
BMA i proces Shawinigan. Jednakże za ok. 25% światowej produkcji
cyjanowodoru odpowiada proces Sohio, w którym HCN tworzy się jako
produkt uboczny otrzymywania akrylonitrylu z propylenu i amoniaku.
Najważniejszą metodą przemysłowego otrzymywania cyjanowodoru jest
proces w którym zachodzi egzotermiczna reakcja metanu z amoniakiem
przy udziale tlenu z powietrza: |
|
|
Proces BMA
Cyjanowodór jest również otrzymywany w procesie BMA. Dochodzi tutaj
do reakcji metanu z amoniakiem w wysokiej temperaturze, również przy
użyciu katalizatora platynowego: |
|
Właściwości
Cyjanowodór jest bezbarwną cieczą o intensywnym zapachu gorzkich
migdałów – próg wyczuwalności wynosi 0,002–0,005 mg/dm³ powietrza.
Niektóre osoby mogą go jednak nie wyczuwać. Wykazuje dużą lotność.
Łatwo miesza się z wodą i alkoholami. Na powietrzu spala się
niebieskim płomieniem. Jego pary tworzą z powietrzem mieszaninę
wybuchową (w granicach 6–41% objętościowych. Kwas cyjanowodory jest
bardzo słaby (pKa = 9,36). W zależności od warunków może
polimeryzować – jego oligomery obejmują aminomalononitryl (trimer) i
diaminomalononitryl (tetramer). Cyjanowodór utlenia się podczas
ogrzewania (300–650 °C) na powietrzu tworząc kwas cyjanowy i w
mniejszych ilościach cyjan: |
|
Zastosowanie Jest stosowany do dezynfekcji i deratyzacji pomieszczeń, np. statków lub magazynów. W postaci soli znajduje zastosowanie w przemyśle metalurgicznym, galwanizacji i klasycznej analizie chemicznej (jony CN− silnie kompleksują metale przejściowe). Cyjanowodór wykorzystywany jest przede wszystkim przy produkcji metakrylanu metylu w przemyśle tworzyw sztucznych oraz w syntezie do otrzymywania cyjanku potasu i sodu, adyponitrylu, metioniny, chlorku cyjanuru, cyjanu, kwasu nitrylotrioctowego i niektórych pestycydów triazynowych. Stosuje się go również do wykonywania kar śmierci w komorze gazowej. Podczas II wojny światowej był stosowany przez Niemców pod nazwą handlową Cyklon B w masowych egzekucjach w obozach koncentracyjnych. W czasie I wojny światowej próbowano wykorzystywać go jako bojowy środek trujący, jednak bez szczególnego powodzenia. Badania nad jego użyciem w tym celu prowadzone były już w 1915 roku i pod koniec tego roku był umieszczany w mieszaninach z chloroformem, trichlorkiem arsenu i chlorkiem cyny(IV) we francuskich pociskach No. 4. Po raz pierwszy został użyty w działaniach bojowych lipcu 1916 roku. Jego oznaczeniami wojskowymi w tym czasie były Forestite i CK. Obecnie jest objęty wykazem 3. Konwencji o zakazie broni chemicznej. Jest silnie toksyczny (dawka śmiertelna dla człowieka o masie 60 kg wynosi ok. 50–60 mg). Cyjanowodór łatwo wchłania się do organizmu przez płuca, skórę i układ pokarmowy, gdzie ulega dysocjacji, a powstające jony cyjankowe CN− łatwo wiążą się z jonami Fe3+ i silnie hamują układ enzymatyczny oksydazy cytochromowej. W efekcie dochodzi do zablokowania przenoszenia tlenu z oksyhemoglobiny do tkanek (krew żylna przy zatruciu cyjankami ma jasnoczerwony kolor, co normalnie jest charakterystyczne dla krwi tętniczej). Zablokowanie enzymów oddechowych jest odwracalne, co wykorzystuje się podczas leczenia osób poszkodowanych – CN− mają znaczne powinowactwo do methemoglobiny, dlatego zatrutemu podaje się azotyn izoamylu lub azotyn sodu, w celu wywołania methemoglobinemii i przywrócenia możliwości transportu tlenu do komórek. Translate to English |
|
|